OXID je DVOUPRVKOVÁ SLOUČENINA kyslíku s některým dalším prvkem. Oxidy různých prvků mají různé vlastnosti. Některé oxidy jsou plynné, jiné kapalné a další pevné. Některé bez zápachu, jiné páchnoucí. Některé pro tělo potřebné, jiné jedovaté. Některé stabilní, jiné výbušné. Vzorec oxidu může vypadat třeba takhle: CaO, H2O, SO3. Abychom ze vzorce oxidu správně určili jeho název, musíme si pamatovat, že ATOM KYSLÍKU má v oxidech OXIDAČNÍ ČÍSLO -II. Oxidační číslo je nezbytné pro tvorbu názvosloví anorganické chemie. Můžeme si jej představit jako náboj na každém atomu. CELKOVÝ NÁBOJ molekuly JE NULOVÝ. Znamená to, že ATOM PRVKU SLOUČENÉHO s kyslíkem má vždy KLADNÉ OXIDAČNÍ ČÍSLO. CELKOVÝ NÁBOJ JE SOUČTEM NÁBOJŮ NA VŠECH ATOMECH, proto musíme oxidační číslo vždy NÁSOBIT POČTEM ATOMŮ, KTERÉ HO NESOU.
Ca+IIO-II protože +II-II = 0 CaO má název OXID VÁPENATÝ
H+I2O-II protože 2.(+I)-II = 0 H2O má název OXID VODNÝ ! používá se název VODA
S+VIO-II3 protože +VI-II.3 = 0 SO3 má název OXID SÍROVÝ
JAK URČÍM KONCOVKU přívlastku oxidu?
Podle OXIDAČNÍHO ČÍSLA PRVKU SLOUČENÉHO s kyslíkem.
Pro oxidační číslo +I je koncovka -ný
Pro oxidační číslo +II je koncovka -natý
Pro oxidační číslo +III je koncovka -itý
Pro oxidační číslo +IV je koncovka -ičitý
Pro oxidační číslo +V je koncovka -ečný nebo -ičný
Pro oxidační číslo +VI je koncovka -ový
Pro oxidační číslo +VII je koncovka -istý
Pro oxidační číslo +VIII je koncovka -ičelý
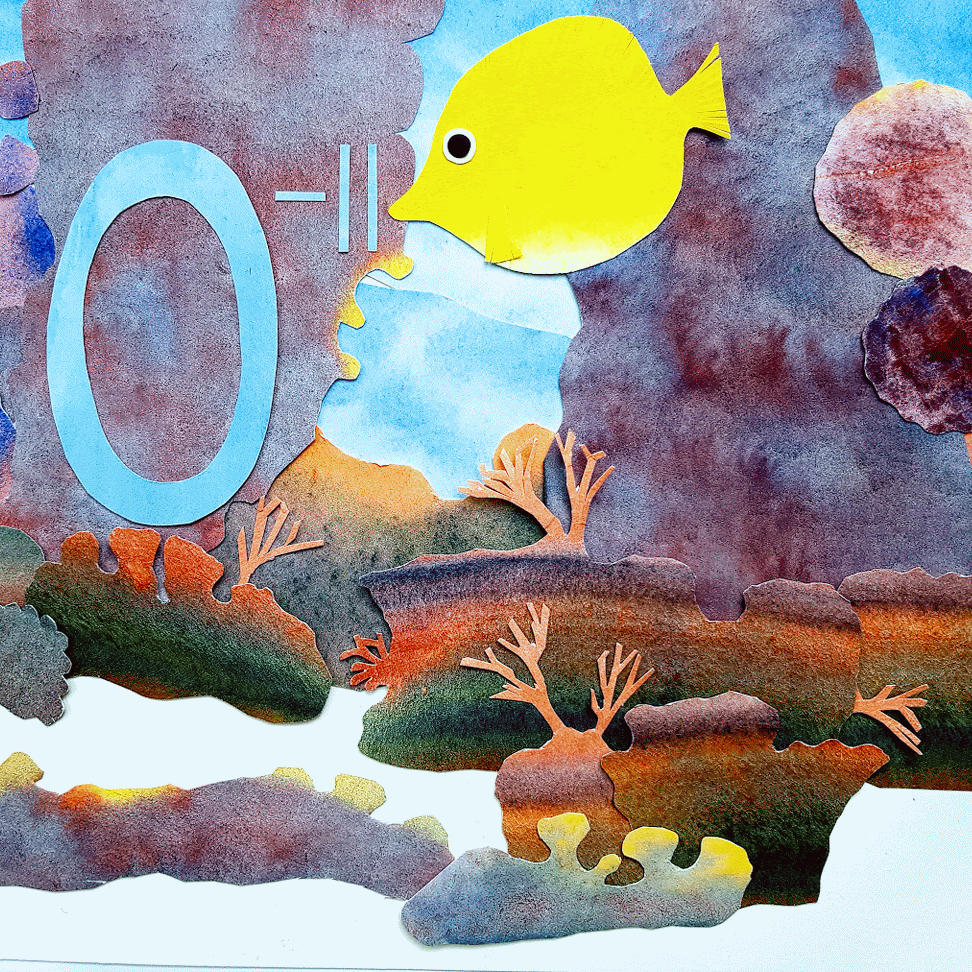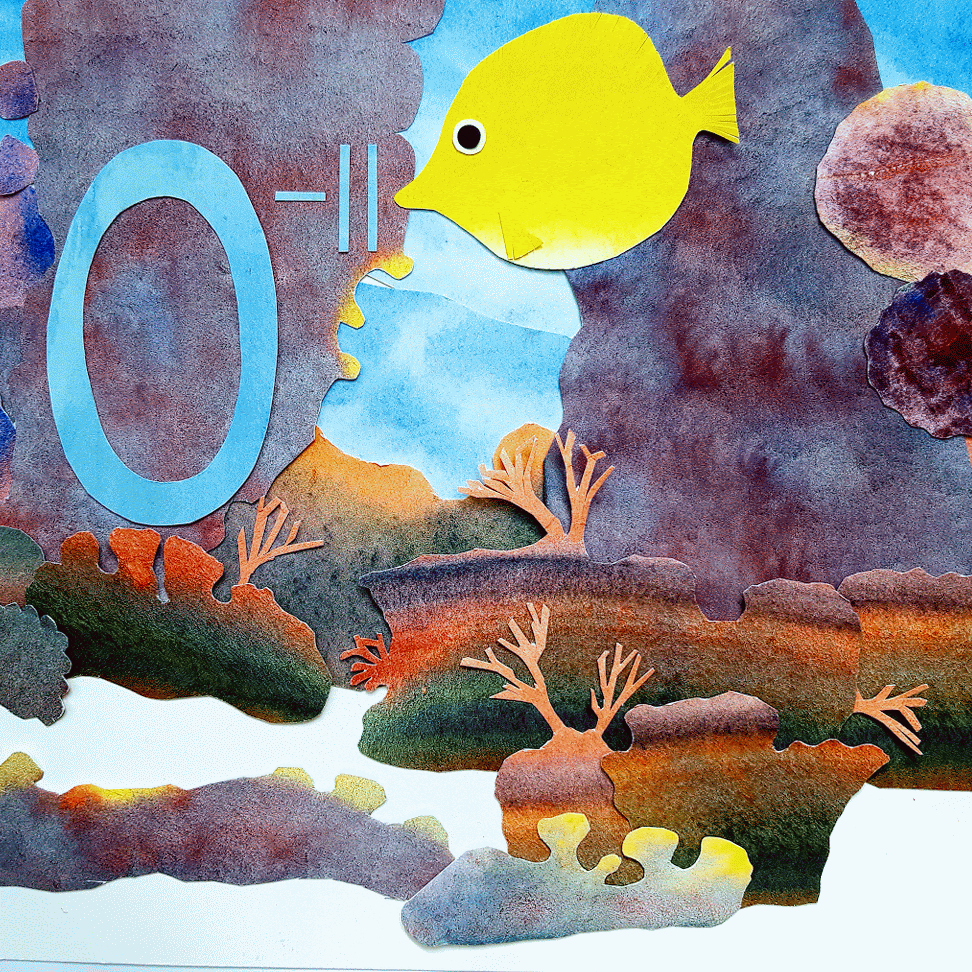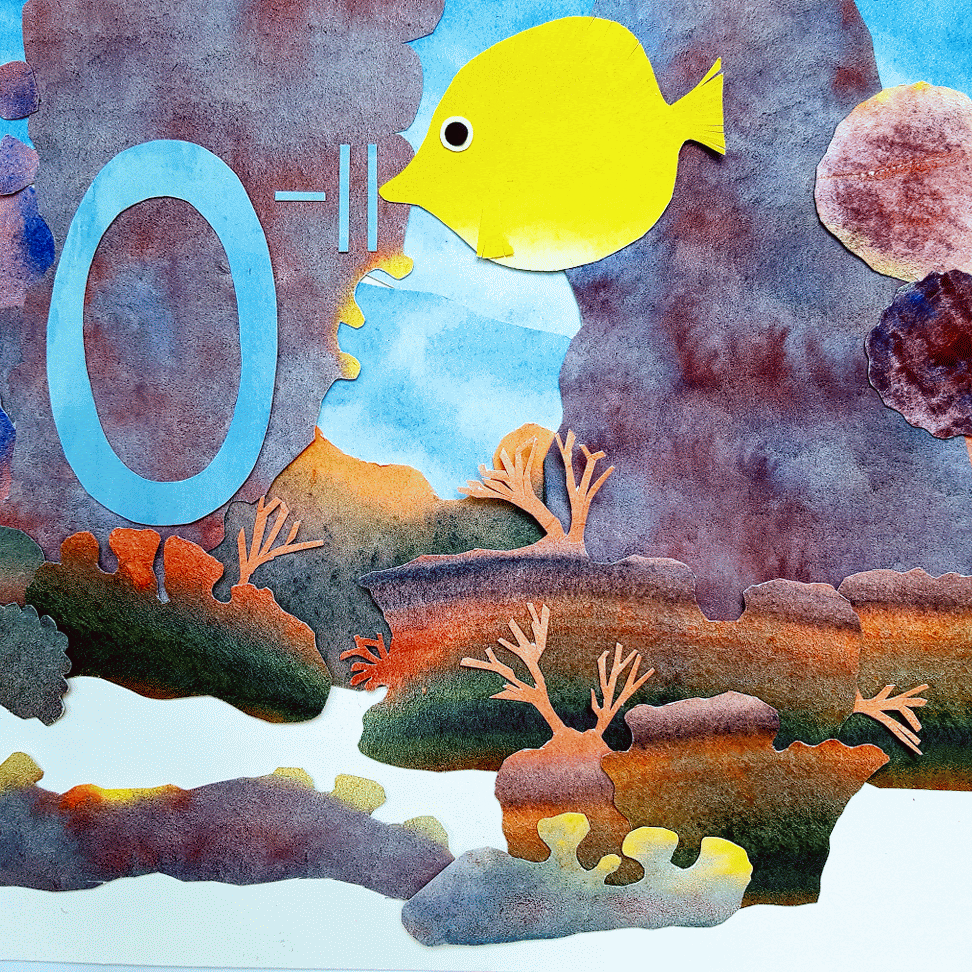
PŘIŘAĎ KE KAŽDÉ LÁTCE JEDEN Z NÁSLEDUJÍCÍCH VZORCŮ: CO2, N2O5, H2O, CO, Fe2O3, Mn2O7, SO3, CaO, SiO2, OsO4, Al2O3, TiO2, Cr2O3, SO2, P2O5, MgO, N2O
OXIDAČNÍ ČÍSLO I
A Voda
B Plyn s narkotickým účinkem
OXIDAČNÍ ČÍSLO II
C Pálené vápno
D Pevná látka vznikající hořením hořčíku
E Plyn vznikající při nedokonalém spalování
OXIDAČNÍ ČÍSLO III
F Zelený pigment
G Červenohnědý pigment i ruda kovu
H Získává se z bauxitu, jeho krystalickou formou je korund
OXIDAČNÍ ČÍSLO IV
I Bílý pigment v bělobě a v nátěrových hmotách
J Nejrozšířenější pevný oxid v zemské kůře
K Plynná látka, kterou rostliny dokáží skvěle využít k tvorbě sacharidů
L Plynná látka, která se vyskytuje tam, kde hoří síra
OXIDAČNÍ ČÍSLO V
M Bílý prášek, který vzniká hořením fosforu na vzduchu
N Krystalická látka, která reakcí s vodou tvoří kyselinu dusičnou
OXIDAČNÍ ČÍSLO VI
O Plyn, který společně s vodou tvoří kyselinu sírovou
OXIDAČNÍ ČÍSLO VII
P Vysoce výbušná zelená kapalná sloučenina manganu s kyslíkem
OXIDAČNÍ ČÍSLO VIII
R Vysoce toxická sloučenina kyslíku s osmiem používaná v daktyloskopii
